炭酸カルシウムの電気音響挙動
概要 希釈することで変質してしまう試料は、高濃度ゼータ電位計を用いて評価することで問題を解消できる。
< 関連ワード:分散液(懸濁液、スラリー)、高濃度(濃厚、原液)、分散安定性、凝集、希釈、ゼータ電位 >
1. はじめに
一般的な粒子径およびゼータ電位測定装置は、測定時に大幅な希釈を必要とする。しかし、ゼータ電位は希釈によるイオン濃度の変化の影響を受けやすいため、測定者は希釈時にイオン濃度を保つよう注意しなければならない。一方で、注意しながら希釈してもゼータ電位が変化してしまう粒子もある。
本アプリケーションでは、炭酸カルシウム(CaCO3)を一例に説明する。CaCO3は低pHで溶解し、イオン濃度が変化するため、ゼータ電位を変化させずに希釈することができない。この問題は、実用濃度で測定可能なZetaProbeやAcoustoSizer IIxを用いることで解決できる。
2. CaCO3に関する問題点
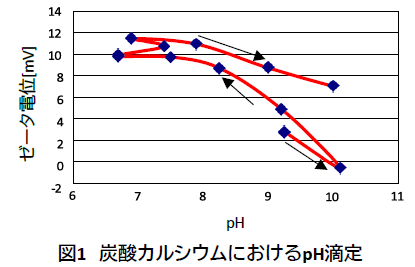
pHを酸側へ調整すると粒子が溶解し始め、炭酸水素イオン(HCO3-)の緩衝作用が増大するため、pH7.0から変化しなくなる。そのため、pH7.0より低いpH領域での粒子特性の評価が難しい。また、pHを酸側に調整することで生じるCa2+により、pHに対するゼータ電位の応答にヒステリシスが生じる。
3. CaCO3における評価事例
次に、この分散液を蒸留水で5.0 vol%まで希釈したところ、pHがわずかにアルカリ側に動き、ゼータ電位の絶対値が大きくなった。この状態でさらに酸の滴定剤を加えると、pHはわずかに酸側に動き、ゼータ電位の絶対値は11.0 mV強までわずかに大きくなった。最後に、pHをアルカリ側へ調整したが、分散液には非常に大きなヒステリシスがあるため、ゼータ電位はプラスのままで絶対値がやや小さくなっただけであった。
4. まとめ
評価事例より、Ca2+が分散液中に多く存在するようになると、粒子表面に吸着しやすくなり、よりプラスのゼータ電位に変化したことがわかる。また、粒子表面を負のゼータ電位にするためには、より多くの水酸化物イオンが必要となり、IEPはより高いpH値まで変化したと考えられる。このような系におけるゼータ電位測定は、ヒステリシスや希釈による影響を受ける。そのため、真のゼータ電位を決定するためには、実用濃度で測定しなければならない。



