【第4回】表面張力を知るには、分子間力を知る
中学や高校の化学の時間に、「イオン結合」「共有結合」「金属結合」というものを習った方が多いかと思います。 これらは原子と原子の間にはたらき、分子を形作るための力です。当然ながら目視で確かめる事は不可能ですが、下図のイメージですね。
これにたいして「分子間力」というものがあります。「van der Waals(ファン・デル・ワールス)力」とも言われます。「分子間力」は分子と分子の間にはたらく力で、液滴やその接触角のように、ある程度目視でも確認できる現象で確認できます。また、原子間の力ほどの安定性はありません。
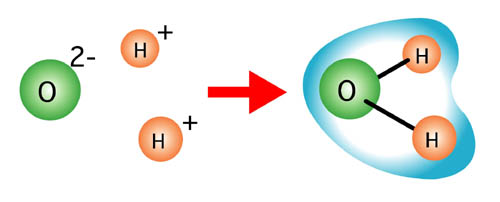
分子は、電気的に中性である・・・というのが高校までの化学ですが、実際以下のようなことが起こっています。
- 実際は分子の中でも構成原子や構造によって電荷(プラスとマイナス)に偏りを生じる。
- 分子は常に振動している。分子そのものに極性がなくても、振動のために電荷が偏る。
- 水素結合〜水素原子(H)と電子を共有しやすい原子との結合(F-H、O-H、N-Hなど)では、 水素原子が+(プラス)に、もう一方が−(マイナス)に帯電して電荷が偏る。
(※注:これら全てが、ファン・デル・ワールス力と言われるわけではありません。)
電荷が偏る(静電気を持つ)ことを「極性を持つ」と言います。 分子が棒磁石になったようなものだと思ってください。 常に極性を持つ分子もあれば、極性が出来たり消えたりする分子もあります。 極性を持った分子は、それぞれマイナス極性の部分が、近くの分子のプラス極性と引かれ合います。 磁石のN極とS極が引かれ合うのと同様です。
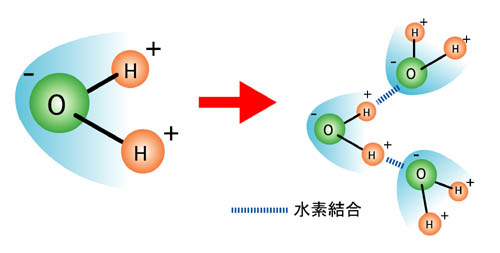
これらの静電気力による引き合いが分子間力、すなわち表面張力の源です。均一の物質も混合した物質も含めて、この力が強くはたらくほど表面張力は強くなります。水の表面張力は、他の液体に比べて抜きん出て高い数値ですが、水は水素結合が高密度に存在できることが原因だと言われています。
(水の異常さについてもこのサイトに掲載する予定でしたが、「ニュートン」2005年10月号/株式会社ニュートンプレス刊行、に水が特集されており、とても充実しておりますので、興味のある方はバックナンバーを取り寄せてみては・・・)





